알프레트 베르너
"오늘의AI위키"의 AI를 통해 더욱 풍부하고 폭넓은 지식 경험을 누리세요.
1. 개요
알프레트 베르너는 1866년 알자스 뮐루즈에서 태어난 스위스 화학자이다. 그는 취리히 대학교에서 박사 학위를 받았으며, 배위 화합물의 구조를 제안하여 무기화학 발전에 기여했다. 1913년 배위 화합물 연구 업적으로 노벨 화학상을 수상했으며, 1919년 뇌동맥경화증으로 사망했다.
더 읽어볼만한 페이지
- 뮐루즈 출신 - 요한 하인리히 람베르트
요한 하인리히 람베르트는 스위스 태생의 독일 과학자, 수학자, 철학자, 천문학자로, 원주율의 무리수성 증명, 쌍곡선 함수 삼각법 도입, 비유클리드 기하학 추측 제시 등 수학과 과학 분야는 물론 '현상학' 용어 사용과 칸트와의 서신 교환 등 철학 분야에도 기여했다. - 뮐루즈 출신 - 알프레드 드레퓌스
알프레드 드레퓌스는 독일 군사 기밀 판매 혐의로 기소되어 종신형을 선고받았으나 재심을 통해 무죄 판결을 받고 복권된 프랑스 육군 장교이다. - 스위스의 화학자 - 레오폴트 루지치카
크로아티아 출신 스위스 과학자 레오폴트 루지치카는 테르펜, 스테로이드 연구, 이소프렌 규칙 제창, 호르몬 합성, 거대 고리 화합물 증명 등 유기화학에 기여하여 1939년 노벨 화학상을 수상했다. - 스위스의 화학자 - 블라디미르 프렐로그
블라디미르 프렐로그는 입체화학에 기여한 크로아티아계 화학자로, 아다만탄 최초 합성, 트뢰거 염기 거울상 이성질체 분리, CIP 체계 개발, 칸-잉골드-프렐로그 순위 규칙 확립 등의 업적을 남겼으며 1975년 노벨 화학상을 수상했다. - 무기화학자 - 드미트리 멘델레예프
드미트리 멘델레예프는 주기율표를 제안하고 멘델레븀의 이름에 영향을 미친 러시아의 화학자이며, 러시아 도량형국 국장으로 미터법 도입에 기여했으며 1907년에 사망했다. - 무기화학자 - 앙리 무아상
프랑스 화학자 앙리 무아상은 불소를 최초로 분리하고 무아상 전기로를 개발한 공로로 노벨 화학상을 수상했으며, 액체 플루오르화수소 전기분해를 통해 순수한 불소를 얻고 전기로를 이용해 붕소 및 인공 다이아몬드 합성 연구와 다양한 붕화물과 탄화물 합성에 기여하여 불소 화학과 무기 화학 발전에 큰 영향을 미쳤다.
2. 생애
알프레트 베르너는 1866년 당시 프랑스령이었던 알자스 뮐루즈에서 태어났다. 가톨릭 집안에서 자랐으며, 아버지는 주물공장 노동자였고 어머니는 부유한 집안 출신이었다.[3] 취리히 연방 공과대학교(ETH Zurich)에서 화학을 공부했으나, 1909년까지 박사 학위를 수여할 권한이 없었기 때문에 1890년 취리히 대학교에서 공식적으로 박사 학위를 받았다.[3] 파리에서 박사후 연구를 마친 후, 취리히 연방 공과대학교로 돌아와 1892년부터 강의를 시작했다. 1893년 취리히 대학교로 자리를 옮겼고, 1895년에는 교수가 되었다. 1894년 스위스 시민권을 취득했다.[3]
알프레트 베르너는 배위 화학과 원자가 이론 분야에서 중요한 업적을 남겼다.
말년에 베르너는 수년간의 과도한 음주와 과로로 악화된, 뇌의 심각한 전반적인 진행성 퇴행성 동맥경화증을 앓았다. 그는 취리히의 정신병원에서 사망했다.[3] 베르너는 52세의 나이로 1919년 11월 15일 취리히에서 동맥경화증으로 사망했다.
3. 주요 연구 업적
베르너는 1893년에 중심 전이 금속 원자에 여러 리간드가 결합한 착이온 구조를 제안했다. 육암민코발트(III) 염화물([Co(NH3)6]Cl3)을 예로 들면, Co3+ 이온이 팔면체 모양으로 여섯 NH3에 둘러싸여 있고, 세 Cl− 이온은 자유롭게 해리된다고 보았다. 전도도 측정, 질산은 침전 실험, 자기화율 분석으로 이를 증명했다.
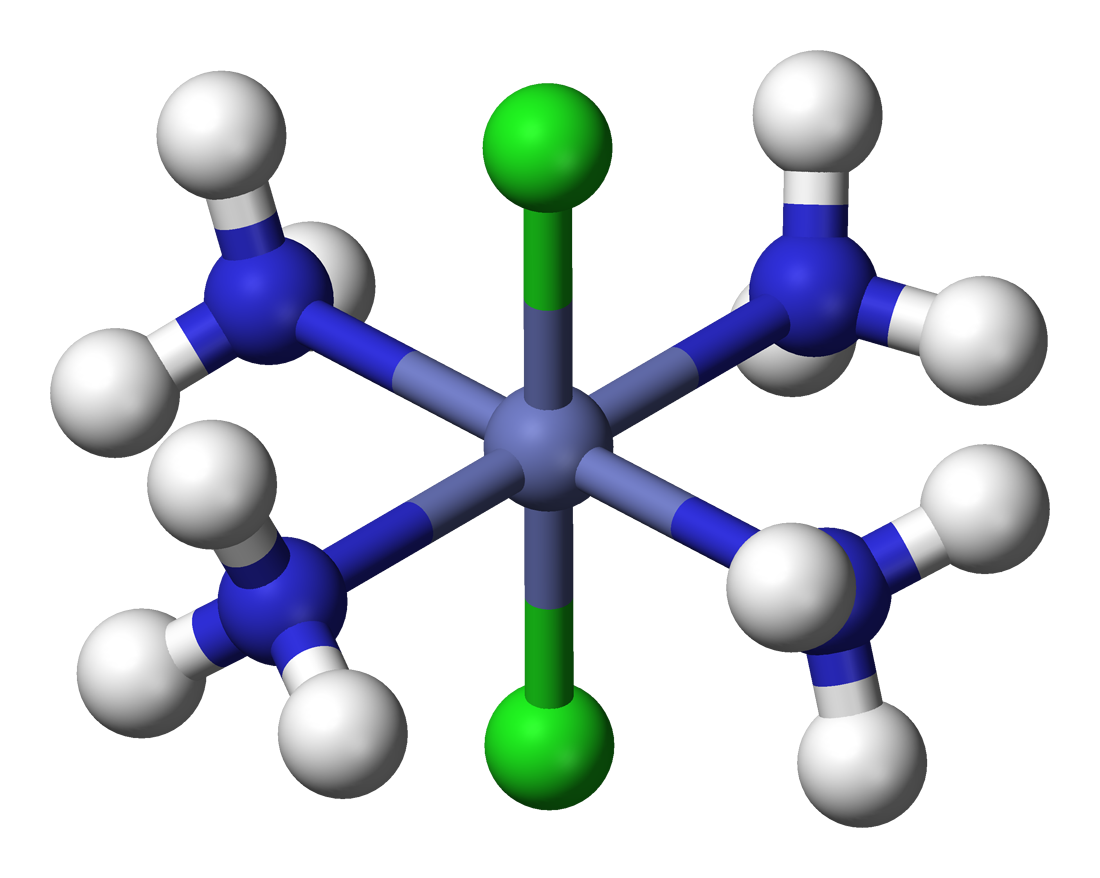
베르너는 리간드 종류가 여럿인 착물에서 나타나는 이성질체 수도 설명했다. [Co(NH3)4Cl2]Cl의 기하 이성질체 두 가지를 제안했는데, 녹색은 두 Cl 리간드가 서로 반대쪽에 있는 트랜스형, 보라색은 인접한 시스형이다.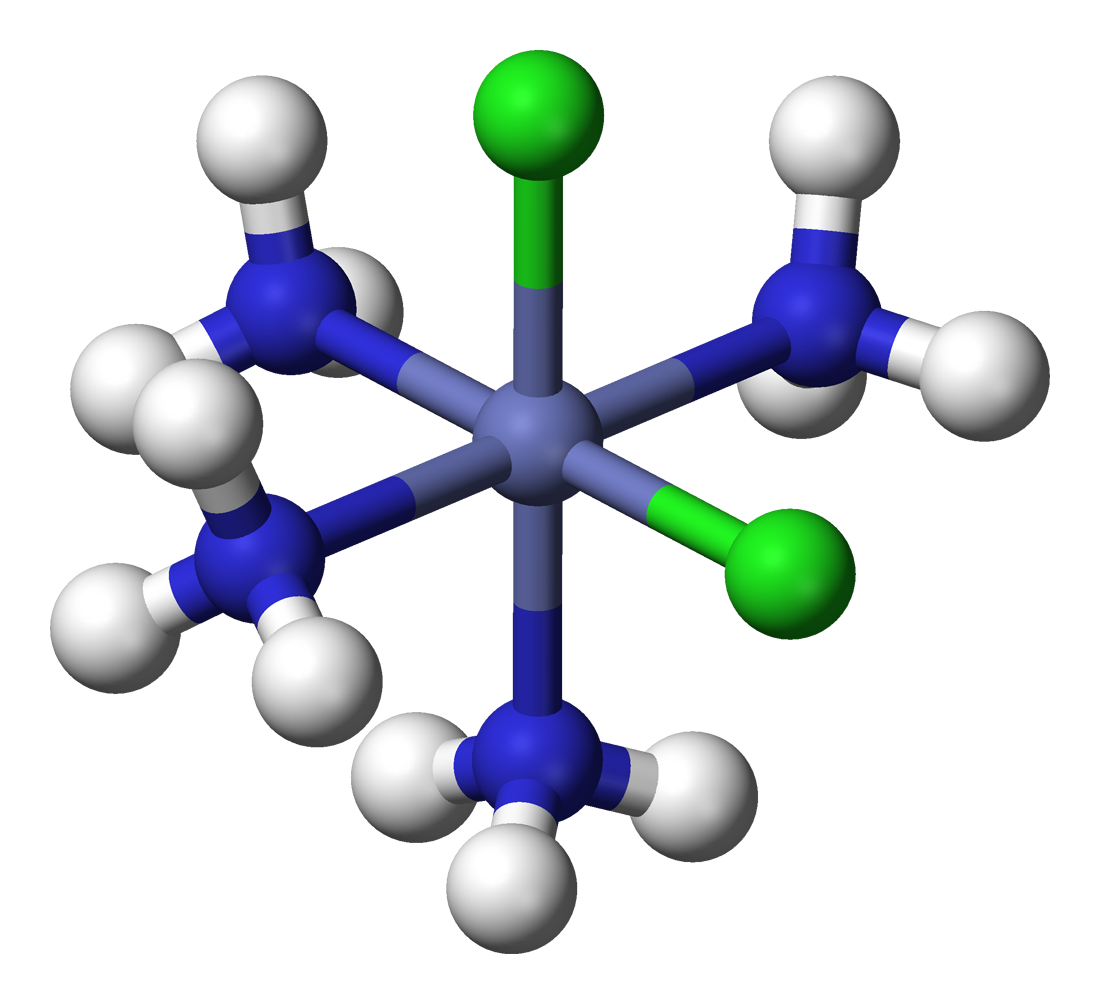
베르너는 광학 이성질체를 갖는 착물도 만들었고, 1914년에는 탄소가 없는 최초의 카이랄 화합물 헥솔을 보고하여, 무기화학에도 카이랄성 개념을 도입했다.
이전에는 원소의 원자가를 결합 수로만 정의했지만, 베르너는 착물에서 Co-Cl 결합은 "일차" 원자가 3, Co-NH3 결합은 "이차" 원자가 6이라고 보았다. 이차 원자가 6을 배위수로 정의했다.
1904년 리하르트 아베크는 아베크의 규칙을 만들었는데, 원소의 최대 양과 음의 원자가 차이가 종종 8이라는 것이다. 이는 1916년 길버트 N. 루이스의 옥텟 규칙에 쓰였다.
현대에는 베르너의 일차 원자값을 산화 상태, 이차 원자값을 배위수로 부른다. Co-Cl 결합은 이온 결합, Co-N 결합은 루이스 산 Co3+와 루이스 염기 NH3 간의 배위 공유 결합이다.
3. 1. 배위 화학
1893년, 베르너는 중심 전이 금속 원자에 여러 개의 중성 또는 음이온 리간드가 결합한 형태의 착이온 구조를 제안했다.Alfred Werner영어
예를 들어, 코발트는 CoCl3•6NH3 화학식을 갖는 육암민코발트(III) 염화물([Co(NH3)6]Cl3)이라는 "착물"을 형성하는데, 여기서 점으로 표시된 결합의 성질은 불분명했다. 베르너는 Co3+ 이온이 팔면체 꼭짓점에 있는 여섯 개의 NH3에 둘러싸여 있고, 세 개의 Cl−는 자유 이온으로 해리된다는 육암민코발트(III) 염화물([Co(NH3)6]Cl3) 구조를 제안했다. 그는 전도도 측정과 질산은을 이용한 침전 실험을 통해 이를 확인했다. 이후 자기화율 분석을 통해서도 베르너의 제안이 옳다는 것이 확인되었다.
베르너는 한 가지 이상의 리간드 유형을 가진 착물에서 관찰되는 이성질체의 수를 성공적으로 설명했다. 예를 들어, 그는 녹색과 보라색의 두 가지 테트라민 이성질체 "Co(NH3)4Cl3"가 존재함을 보였다. 베르너는 이들이 하나의 Cl− 이온이 해리된 [Co(NH3)4Cl2]Cl의 기하 이성질체 두 가지라고 제안했다. 즉, Co 원자는 팔면체 꼭짓점에 있는 네 개의 NH3와 두 개의 Cl 리간드에 둘러싸여 있으며, 녹색 이성질체는 두 Cl 리간드가 서로 반대쪽 꼭짓점에 있는 트랜스형이고, 보라색 이성질체는 두 Cl이 인접한 꼭짓점에 있는 시스형이다.
베르너는 광학 이성질체를 가진 착물도 제조했으며, 1914년에는 화학식이 [Co(Co(NH3)4(OH)2)3]Br6인 탄소를 포함하지 않는 최초의 합성 카이랄 화합물인 헥솔을 보고했다. 이로써 그는 유기화학에만 국한되었던 키랄성 개념을 무기화학으로 확장했다.
3. 2. 원자가 이론
베르너 이전의 화학자들은 원소의 원자가를 결합 종류를 구분하지 않고 결합의 수로 정의했다. 그러나 [Co(NH3)6]Cl3과 같은 착물에서 베르너는 Co-Cl 결합은 긴 거리에서 "일차" 원자가 3에 해당하고, Co-NH3 결합은 짧은 거리에서 "이차" 또는 약한 원자가 6에 해당한다고 생각했다. 그는 이 이차 원자가 6을 배위수라고 언급했는데, 이는 중심 금속 원자에 직접 연결된 분자(여기서는 NH3)의 수로 정의했다. 다른 착물에서 그는 4 또는 8의 배위수를 발견했다.
이러한 견해와 유사한 다른 견해를 바탕으로 1904년 리하르트 아베크는 아베크의 규칙을 공식화했는데, 이는 원소의 최대 양의 원자가와 최대 음의 원자가의 차이가 종종 8이라는 것이다. 이 규칙은 1916년 길버트 N. 루이스가 입방 원자 이론에서 "옥텟 규칙"을 공식화할 때 사용되었다.
현대 용어로 베르너의 일차 원자값은 산화 상태에 해당하고, 그의 이차 원자값은 배위수라고 한다. Co-Cl 결합(위의 예에서)은 이온 결합으로 분류되며, 각 Co-N 결합은 루이스 산 Co3+와 루이스 염기 NH3 사이의 배위 공유 결합이다.
4. 영향
알프레트 베르너의 배위 화학 이론은 무기화학의 새로운 지평을 열었으며, 착화합물 연구에 획기적인 발전을 가져왔다. 그의 연구는 현대 배위 화학, 결정장 이론, 리간드장 이론 등의 발전에 중요한 토대가 되었다. 1913년, 베르너는 배위 화합물에 대한 연구 업적을 인정받아 노벨 화학상을 수상했다.
참조
[1]
웹사이트
Alfred Werner - Nobel Prize for Chemistry 1913
https://www.uzh.ch/c[...]
2022-12-09
[2]
웹사이트
Nobel Prize
https://www.nobelpri[...]
2012-12-01
[3]
웹사이트
Alfred Werner - Swiss chemist
http://www.britannic[...]
2018-04-14
본 사이트는 AI가 위키백과와 뉴스 기사,정부 간행물,학술 논문등을 바탕으로 정보를 가공하여 제공하는 백과사전형 서비스입니다.
모든 문서는 AI에 의해 자동 생성되며, CC BY-SA 4.0 라이선스에 따라 이용할 수 있습니다.
하지만, 위키백과나 뉴스 기사 자체에 오류, 부정확한 정보, 또는 가짜 뉴스가 포함될 수 있으며, AI는 이러한 내용을 완벽하게 걸러내지 못할 수 있습니다.
따라서 제공되는 정보에 일부 오류나 편향이 있을 수 있으므로, 중요한 정보는 반드시 다른 출처를 통해 교차 검증하시기 바랍니다.
문의하기 : help@durumis.com
